■燃料電池
燃料電池とは、水の電気分解の逆で、水素と酸素を反応させることによって電気を得るものです。
・・・ とよくいわれます。
何となく分かったような分からないような・・・。
水素と酸素を反応させたら、中学校の時にした水素の爆発実験のように爆発してしまいそうじゃないですか。
そうです。
直接反応させると爆発してしまいます。
ですから燃料電池では、ゆっくりじわじわと反応させるために、水素と酸素が直接ふれあわないよな特殊な膜を通してゆっくりと反応させます。
膜の種類や温度や電解液の種類によって、いろんな種類の燃料電池が開発されています。
詳しいことは難しいので、簡単に説明していきます。
その前に水の電気分解について↓
■水の電気分解
水の電気分解とは、水に電気を流して水を水素と酸素に分解することです。
水が分解されるなんて驚きです。
中学校の理科を思い出してみて下さい。
水は化学式で「H2O」と表します。
水素は「H」、酸素は「O」です。
こうしてみると水は酸素と水素に分かれそうですね。
ちなみに「H」や「O」は原子という存在で、単独では存在できません。
何かと結びついてこの世に存在できるものです。
ですから、空気中にある酸素は「O」が2つ結びついた「O2」という分子の形で存在します。
水素も同様に「H2」となります。
これを化学式で表してみると、水の電気分解の場合、
2H2O → 2H2 + O2
となります。
ところが、純粋な水は電気を通しません。
ということは水に電気を流して分解ができないことになります。
おかしいですね。
正確には水は少し電離(ひとつのものが+と-の性質を持ったものに分かれること:この場合、電気を通す)していて、高電圧を掛けてやれば電気が流れないこともありません。
水の電離
H2O → H+ + OH-
しかし効率が悪いので、電流が流れやすいように水酸化ナトリウムや硫酸を加えて水溶液にし、電気分解をおこないます。
このとき、水酸化ナトリウムや硫酸は変化しません。
水酸化ナトリウムの場合、水に溶かすと次のように電離します。
NaOH → Na+ +OH-
つまり水の中では
H2O → H+ + OH-
NaOH → Na+ +OH-
が存在することになります。
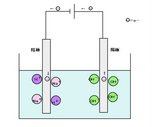
この様子を模式図で表すと下の図のようになります。
それぞれの数を2倍しています。
(図の中の文字の配置が下手ですみません・・・。)
【水の電気分解】
(クリックで拡大します。)
※電気分解の場合、電池の+極を陽極、-極を陰極といいます。
※電流は+から-へ流れますが、本質は、電子(e-)が-から+へ動いています。
水中では水酸化ナトリウムと水は電離していてH+、Na+、OH-の電気を持ったイオンという状態になっています。
電気を流してやると陰極に電子がやってきます。
すると+の電気を持ったH+とNa+が電子の-に引かれて集まってきます。
このとき、H+は陰極から電子の-をもらって、電気的に中性のHとなります。
Hはもう一つのHと結びついてH2となり、水素として空気中に逃げていきます。
水素の発生です。
Na+は電子をもらうよりもイオンのままの方が安定しているので、変化はありません。
陽極ではその逆のことが起こっています。
電気を流すと陽極は電子が足りない状態になり、-の電気を持ったOH-が集まってきます。
そして-の電子を陽極に渡して電気的に中性のOHとなります。
OHは4つのOHと結びついて2H2OとO2になります。
つまり水と酸素ができるのです。
こうして酸素が発生します。
水の分解をもう一度化学式で表すと、
2H2O → 2H2 + O2
となります。
これを電子(e-)のやりとりが分かるように表すと(電流のやりとり)、
2H2O + 2e- → H2 + 2OH-
2OH- → H2O + 1/2 O2 + 2e-
上の2つの式からe-を消去すると
H2O → H2 + 1/2 O2
これを2倍すると、
2H2O → 2H2 + O2 (水の分解)
となります。
(一般的には電気で分解するのですが、水を分解するのに電気を用いない方法もあります。)